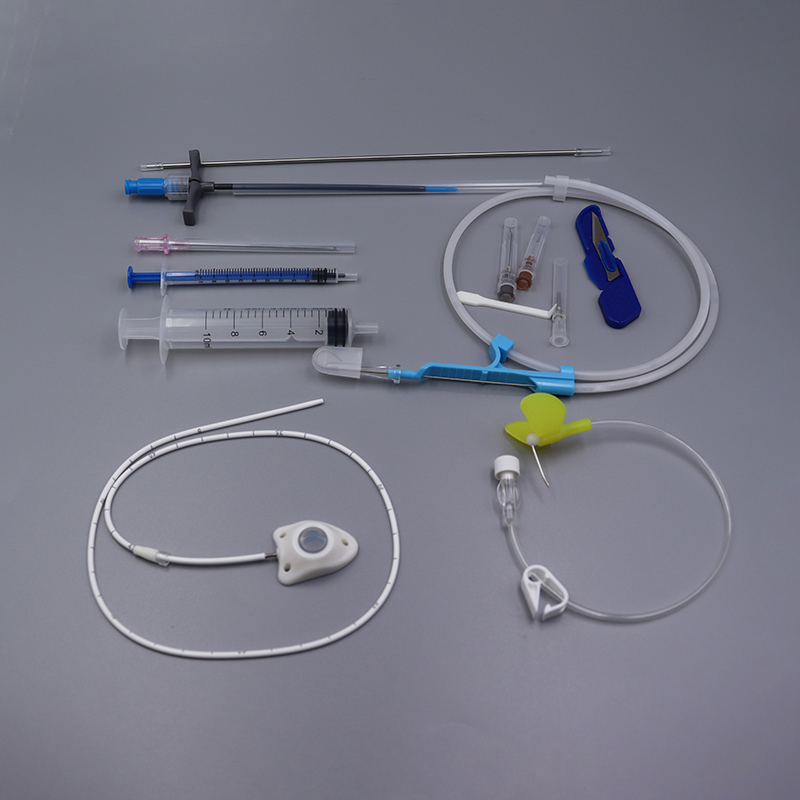
[Anvendelse] Den vaskulære enhedimplanterbar porter egnet til vejledt kemoterapi for en række maligne tumorer, profylaktisk kemoterapi efter tumorresektion og andre læsioner, der kræver langvarig lokal administration.
[Specifikation]
| Model | Model | Model |
| I-6,6Fr×30 cm | II-6,6Fr×35 cm | III- 12,6 Fr × 30 cm |
【Ydeevne】Injektionsholderens selvtætnende elastomer muliggør 22GA nåle i en implanterbar port til 2000 punkteringer. Produktet er fremstillet udelukkende af medicinske polymerer og er metalfrit. Kateteret er røntgendetekterbart. Steriliseret med ethylenoxid, til engangsbrug. Anti-refluks design.
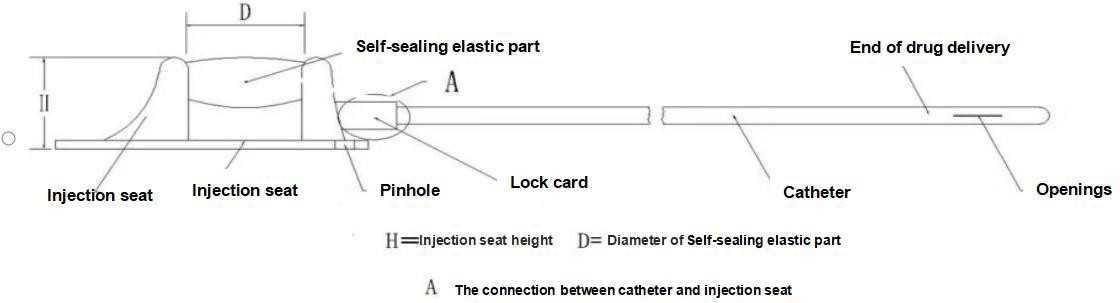
【Struktur】Denne anordning består af et injektionssæde (inklusive selvtætnende elastiske dele, punkteringsbegrænsningsdele, låseklips) og et kateter, og type II-produktet er udstyret med en låseklipsforstærker. Kateteret og den selvtætnende elastiske membran i den implanterbare lægemiddelafgivelsesanordning er lavet af medicinsk silikonegummi, og de andre komponenter er lavet af medicinsk polysulfon. Følgende diagram introducerer produktets hovedstruktur og komponentnavne, hvor type I er et eksempel.
【Kontraindikationer】
1) Psykisk eller fysisk uegnethed til kirurgi under generelle forhold
2) Alvorlige blødnings- og koagulationsforstyrrelser.
3) Antal hvide blodlegemer mindre end 3×109/L
4) Allergisk over for kontrastmidler
5) Kombineret med svær kronisk obstruktiv lungesygdom.
6) Patienter med kendt eller mistænkt allergi over for materialerne i enhedens emballage.
7) Tilstedeværelse af eller mistanke om enhedrelateret infektion, bakteriæmi eller sepsis.
8) Strålebehandling på det tilsigtede indsættelsessted.
9) Billeddiagnostik eller injektion af emboliske lægemidler.
【Fremstillingsdato】 Se produktets etiket
【Udløbsdato】 Se produktetiketten
【Påføringsmetode】
- Klargør den implanterbare portenhed, og kontroller, om udløbsdatoen er overskredet; fjern den indre emballage, og kontroller, om emballagen er beskadiget.
- Brug aseptiske teknikker til at åbne den indre emballage og fjerne produktet inden klargøring til brug.
- Brugen af implanterbare portenheder beskrives separat for hver model som følger.
TypeⅠ
- Skylning, udluftning, lækagetest
Brug en sprøjte (nål til implanterbar portanordning) til at punktere den implanterbare portanordning, og injicér 5 ml-10 ml fysiologisk saltvand for at skylle injektionssædet og kateterlumen og ekskludere. Hvis der ikke findes nogen eller langsom væske, drej kateterets lægemiddelafgivelsesende (distale ende) med hånden for at åbne lægemiddelafgivelsesporten. Fold derefter kateterets lægemiddelafgivelsesende sammen, og fortsæt med at presse saltvandet ind (tryk ikke over 200 kPa). Kontroller, om der er lækage fra injektionssædet og kateterforbindelsen. Når alt er normalt, kan kateteret bruges.
- Kanylering og ligering
I henhold til den intraoperative undersøgelse indsættes kateteret (lægemiddelafgivelsesenden) i det tilsvarende blodforsyningskar i henhold til tumorens placering, og der anvendes ikke-absorberbare suturer til at ligere kateteret korrekt til karret. Kateteret skal ligeres korrekt (to eller flere passager) og fikseres.
- kemoterapi og forsegling
Intraoperativ kemoterapi kan injiceres én gang i henhold til behandlingsplanen; det anbefales at skylle injektionssædet og kateterlumen med 6-8 ml fysiologisk saltvand, efterfulgt af 3 ml ~ 5 ml. Kateteret forsegles derefter med 3 ml til 5 ml heparinsaltvand ved 100 U/ml til 200 U/ml.
- Fastgørelse af injektionssæde
Et subkutant cystisk hulrum skabes på et støttested, som er 0,5 cm til 1 cm fra hudoverfladen, og injektionssædet placeres i hulrummet og fikseres, og huden sys sammen efter streng hæmostase. Hvis kateteret er for langt, kan det vikles til en cirkel i den proximale ende og fikseres korrekt.
Type II
1. Skylning og udluftning
Brug en sprøjte (nål til implanterbar portanordning) til at injicere saltvand i henholdsvis injektionssædet og kateteret for at skylle og fjerne luften i lumen, og observer om ledningsvæsken er jævn.
2. Kanylering og ligering
I henhold til den intraoperative undersøgelse indsættes kateteret (lægemiddelafgivelsesenden) i det tilsvarende blodforsyningskar i henhold til tumorens placering, og kateteret ligeres korrekt til karret med ikke-absorberbare suturer. Kateteret skal ligeres korrekt (to eller flere passager) og fikseres.
3. Forbindelse
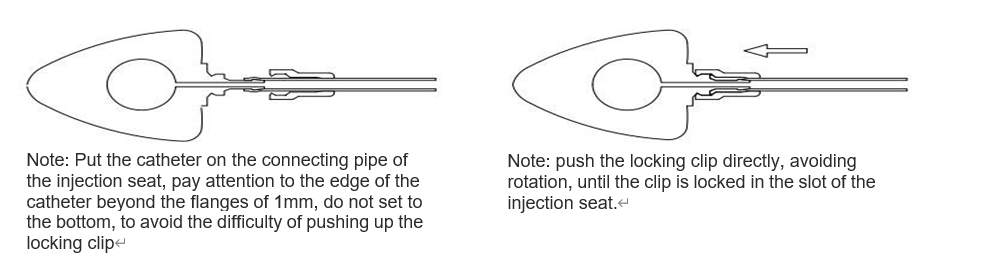
Bestem den nødvendige kateterlængde i henhold til patientens tilstand, afskær overskydende kateter fra den proximale ende af kateteret (ikke-doseringsenden), og indsæt kateteret i injektionssædets tilslutningsrør ved hjælp af
Brug låseklipsforstærkeren til at skubbe låseklipsen fast ind i tæt kontakt med injektionsholderen. Træk derefter forsigtigt kateteret udad for at kontrollere, at det sidder fast. Dette gøres som vist i
Figur nedenfor.
4. Lækagetest
4. Når tilslutningen er fuldført, foldes og lukkes kateteret bag på låseklipsen, og der fortsættes med at injicere saltvand i injektionssædet med en sprøjte (nål til implanterbar lægemiddelafgivelsesanordning) (tryk over 200 kPa). (tryk ikke over 200 kPa) observeres, om der er lækage fra injektionsblokken og kateteret.
forbindelse, og brug den kun, når alt er normalt.
5. Kemoterapi, forseglingsrør
Intraoperativ kemoterapi kan injiceres én gang i henhold til behandlingsplanen; det anbefales at skylle injektionsbasen og kateterlumen med 6~8 ml fysiologisk saltvand igen og derefter bruge 3 ml~5 ml fysiologisk saltvand.
Kateteret forsegles derefter med 3 ml til 5 ml heparin-saltvand ved 100 U/ml til 200 U/ml.
6. Fiksering af injektionssæde
Et subkutant cystisk hulrum blev dannet på et støttested, 0,5 cm til 1 cm fra hudoverfladen, og injektionssædet blev placeret i hulrummet og fikseret, og huden blev sutureret efter streng hæmostase.
Type Ⅲ
En sprøjte (speciel nål til implanterbar portenhed) blev brugt til at injicere 10 ml ~ 20 ml normal saltvandsopløsning i den implanterbare lægemiddelafgivelsesanordning for at skylle injektionssædet og kateterhulrummet, fjerne luften i hulrummet og observere, om væsken var diskret.
2. Kanylering og ligering
I henhold til den intraoperative undersøgelse indføres kateteret langs bugvæggen, og den åbne del af kateterets lægemiddelafgivelsesende skal trænge ind i bughulen og være så tæt på tumormålet som muligt. Vælg 2-3 punkter at ligere og fiksere kateteret.
3. kemoterapi, forseglingsrør
Intraoperativ kemoterapi kan injiceres én gang i henhold til behandlingsplanen, og derefter forsegles røret med 3 ml ~ 5 ml 100 U/ml ~ 200 U/ml heparin-saltvand.
4. Fiksering af injektionssæde
Et subkutant cystisk hulrum blev dannet på et støttested, 0,5 cm til 1 cm fra hudoverfladen, og injektionssædet blev placeret i hulrummet og fikseret, og huden blev sutureret efter streng hæmostase.
Lægemiddelinfusion og -pleje
EN.Strengt aseptisk drift, korrekt valg af injektionssædets placering før injektion og streng desinfektion af injektionsstedet.B. Ved injektion skal du bruge en nål til en implanterbar portanordning, en sprøjte på 10 ml eller mere, hvor venstre pegefinger rører punkteringsstedet og tommelfingeren spænder huden, mens injektionssædet fastgøres. Højre hånd holder sprøjten lodret ned i nålen, undgå at ryste eller rotere, og injicer langsomt 5 ml ~ 10 ml saltvand, når der er en følelse af at falde, og nålespidsen efterfølgende rører bunden af injektionssædet. Kontroller, om lægemiddelafgivelsessystemet er glat (hvis det ikke er glat, bør du først kontrollere, om nålen er blokeret). Observer, om der er nogen hævning af den omgivende hud, når du trykker.
C. Tryk langsomt kemoterapeutisk medicin ind efter at have bekræftet, at der ikke er nogen fejl. Vær opmærksom under trykprocessen for at observere, om den omgivende hud er hævet eller bleg, og om der er lokal smerte. Efter tryk skal medicinen holdes i 15 sekunder til 30 sekunder.
D. Efter hver injektion anbefales det at skylle injektionssædet og kateterlumen med 6~8 ml fysiologisk saltvand og derefter forsegle kateteret med 3 ml~5 ml 100 U/ml~200 U/ml heparinsaltvand. Når de sidste 0,5 ml heparinsaltvand er injiceret, skal lægemidlet skubbes, mens det trækkes tilbage, så lægemiddelindføringssystemet fyldes med heparinsaltvand for at forhindre lægemiddelkrystallisering og blodkoagulation i kateteret. Kateteret skal skylles med heparinsaltvand en gang hver 2. uge i kemoterapiintervallet.
E. Efter injektionen desinficeres nåleøjet med medicinsk desinfektionsmiddel, dækkes med en steril forbinding, og det lokale område holdes rent og tørt for at forhindre infektion på punkteringsstedet.
F. Vær opmærksom på patientens reaktion efter lægemiddeladministration, og observer nøje under lægemiddelinjektionen.
【Forsigtighed, advarsel og suggestivt indhold】
- Dette produkt er steriliseret med ethylenoxid og er gyldigt i tre år.
- Læs venligst brugsanvisningen inden brug for at sikre sikkerheden ved brug.
- Brugen af dette produkt skal overholde kravene i de relevante praksisregler og forskrifter inden for den medicinske sektor, og indsættelse, betjening og fjernelse af disse anordninger bør begrænses til certificerede læger. Indsættelse, betjening og fjernelse af disse anordninger er begrænset til certificerede læger, og postoperativ pleje bør udføres af kvalificeret medicinsk personale.
- Hele proceduren skal udføres under aseptiske forhold.
- Kontrollér produktets udløbsdato og den indre emballage for skader inden proceduren.
- Produktet kan forårsage biologiske farer efter brug. Følg venligst gældende lægepraksis og alle relevante love og regler for håndtering og behandling.
- Brug ikke for stor kraft under intubation, og indfør arterien præcist og hurtigt for at undgå vasospasme. Hvis intubation er vanskelig, kan du bruge fingrene til at dreje kateteret fra side til side, mens du indfører slangen.
- Længden af kateteret, der placeres i kroppen, skal være passende. For langt kateter krøller let i en vinkel, hvilket resulterer i dårlig ventilation. For kort kateter er, når patienten ved voldsomme aktiviteter kan løsne sig fra karret. Hvis kateteret er for kort, kan det løsne sig fra karret, når patienten bevæger sig kraftigt.
- Kateteret skal indsættes i karret med mere end to ligaturer og passende tæthed for at sikre jævn lægemiddelinjektion og for at forhindre kateteret i at glide af.
- Hvis den implanterbare portanordning er af type II, skal forbindelsen mellem kateteret og injektionssædet være fast. Hvis intraoperativ lægemiddelinjektion ikke er nødvendig, bør der anvendes normal saltvandstestinjektion til bekræftelse, før huden sutureres.
- Ved adskillelse af det subkutane område bør der udføres tæt hæmostase for at undgå dannelse af lokalt hæmatom, væskeophobning eller sekundær infektion efter operationen; den vesikulære sutur bør undgå injektionssædet.
- Medicinske α-cyanoacrylatklæbemidler kan beskadige injektionsbasematerialet; brug ikke medicinske α-cyanoacrylatklæbemidler ved behandling af det kirurgiske snit omkring injektionsbasen. Brug ikke medicinske α-cyanoacrylatklæbemidler ved håndtering af kirurgiske snit omkring injektionsbasen.
- Udvis ekstrem forsigtighed for at undgå lækage af kateteret på grund af utilsigtet skade fra kirurgiske instrumenter.
- Ved punktering skal nålen indsættes lodret, der skal anvendes en sprøjte med en kapacitet på 10 ml eller mere, lægemidlet skal injiceres langsomt, og nålen skal trækkes ud efter en kort pause. Tryktrykket må ikke overstige 200 kPa.
- Brug kun specialnåle til implanterbare lægemiddelafgivelsesenheder.
- Når en længere infusion eller udskiftning af lægemidlet er nødvendig, er det hensigtsmæssigt at anvende en implanterbar engangsmedicinafgivelsesanordning med en speciel infusionsslange eller -T-stykke for at reducere antallet af punkteringer og mindske påvirkningen af patienten.
- Reducer antallet af punkteringer, reducer skaden på patientens muskler og selvtætnende elastiske dele. I perioden med seponering af lægemiddelinjektion er antikoagulantinjektion påkrævet en gang hver anden uge.
- Dette produkt er et engangsprodukt, sterilt, ikke-pyrogent, der destrueres efter brug. Genbrug er strengt forbudt.
- Hvis den indre emballage er beskadiget, eller produktets udløbsdato er overskredet, bedes du returnere den til producenten til bortskaffelse.
- Antallet af punkteringer for hver injektionsblok bør ikke overstige 2000 (22Ga). 21.
- Den minimale skyllemængde er 6 ml
【Opbevaring】
Dette produkt skal opbevares i et giftfrit, ikke-ætsende gasformigt, godt ventileret, rent miljø og forhindres i at udskilles.
Opslagstidspunkt: 25. marts 2024